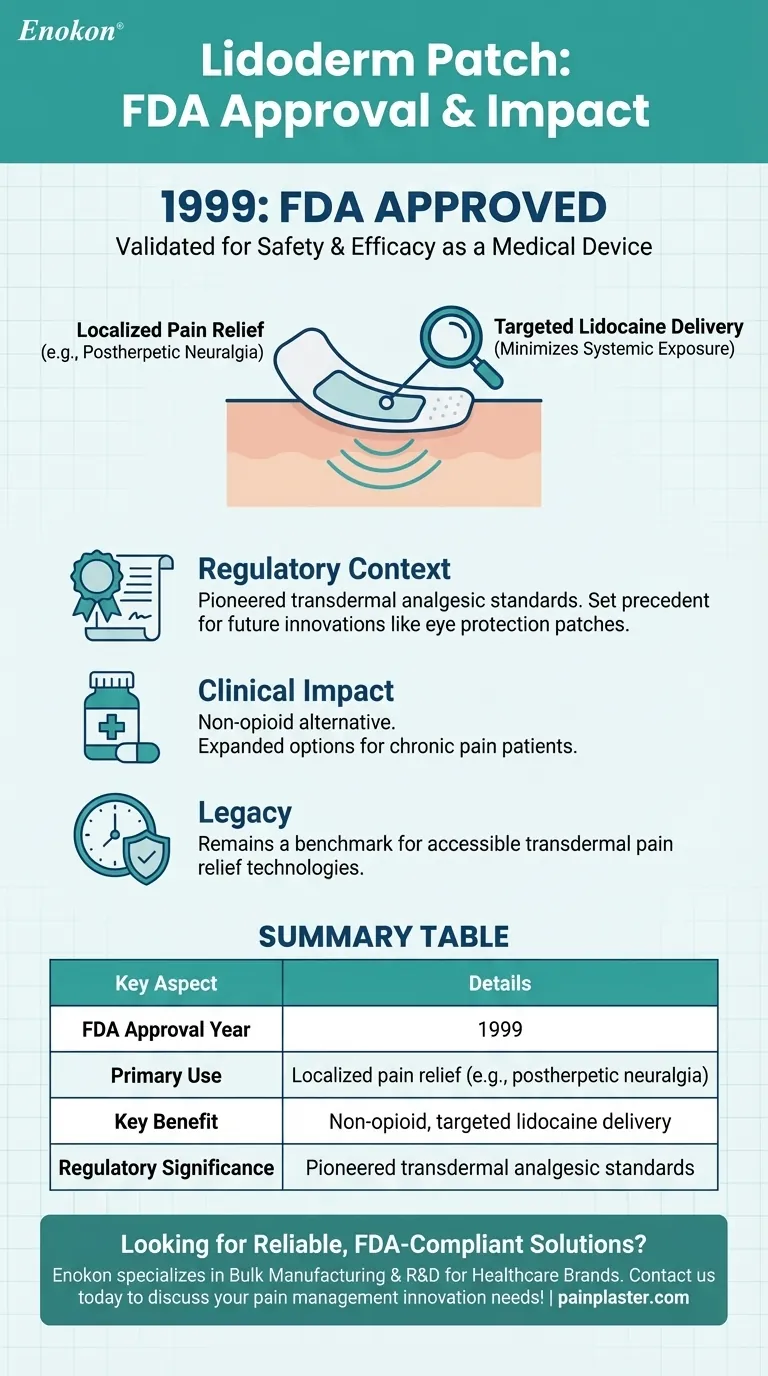
Lidoderm 贴片是一种局部镇痛贴片,于 1999 年获得美国食品及药物管理局的批准。这一批准标志着它作为一种利用利多卡因提供局部治疗的止痛医疗设备问世。该贴片的设计和功效符合此类产品所需的监管标准,确保需要非侵入性疼痛治疗解决方案的患者可以使用。
要点说明:
-
FDA 批准年份:
- Lidoderm 贴片于 1999 年获得美国食品和药物管理局(FDA)批准。 1999 .这一里程碑验证了其临床应用的安全性和有效性。
- 在审批过程中进行了严格的测试,以确保该贴片符合有效输送利多卡因且无全身副作用的标准。
-
目的和设计:
- 该贴片用于局部止痛,尤其适用于带状疱疹后遗神经痛(与带状疱疹有关的疼痛)等疾病。
- 它的粘合剂背衬可以有针对性地输送利多卡因,最大限度地减少对身体其他部位的暴露。
-
监管背景:
- Lidoderm 贴片于 1999 年获得美国食品及药物管理局的批准,成为早期局部镇痛创新产品之一。
- 它开创了类似产品的先例,包括 护眼贴 后来又用于不同的治疗用途。
-
临床影响:
- 该贴片为疼痛治疗提供了一种非阿片类药物的替代方法,符合人们对减少系统性药物使用的日益重视。
- 它的获批扩大了慢性疼痛患者的选择范围,尤其是那些对口服药物敏感的患者。
Lidoderm 贴片仍然是透皮止痛的基准,反映了 FDA 在推动无障碍医疗保健技术方面所发挥的作用。
汇总表:
| 主要方面 | 详细信息 |
|---|---|
| FDA 批准年份 | 1999 |
| 主要用途 | 局部止痛(如带状疱疹后神经痛) |
| 主要优点 | 非阿片类、靶向利多卡因给药,全身暴露量极低 |
| 监管意义 | 首创透皮镇痛标准 |
您在寻找可靠的、符合FDA标准的透皮镇痛解决方案吗? 伊诺康 专门从事高品质镇痛贴片的批量生产和医疗保健品牌的定制研发。 今天就联系我们 讨论您的需求,利用我们在疼痛管理创新方面的专业知识!
图解指南