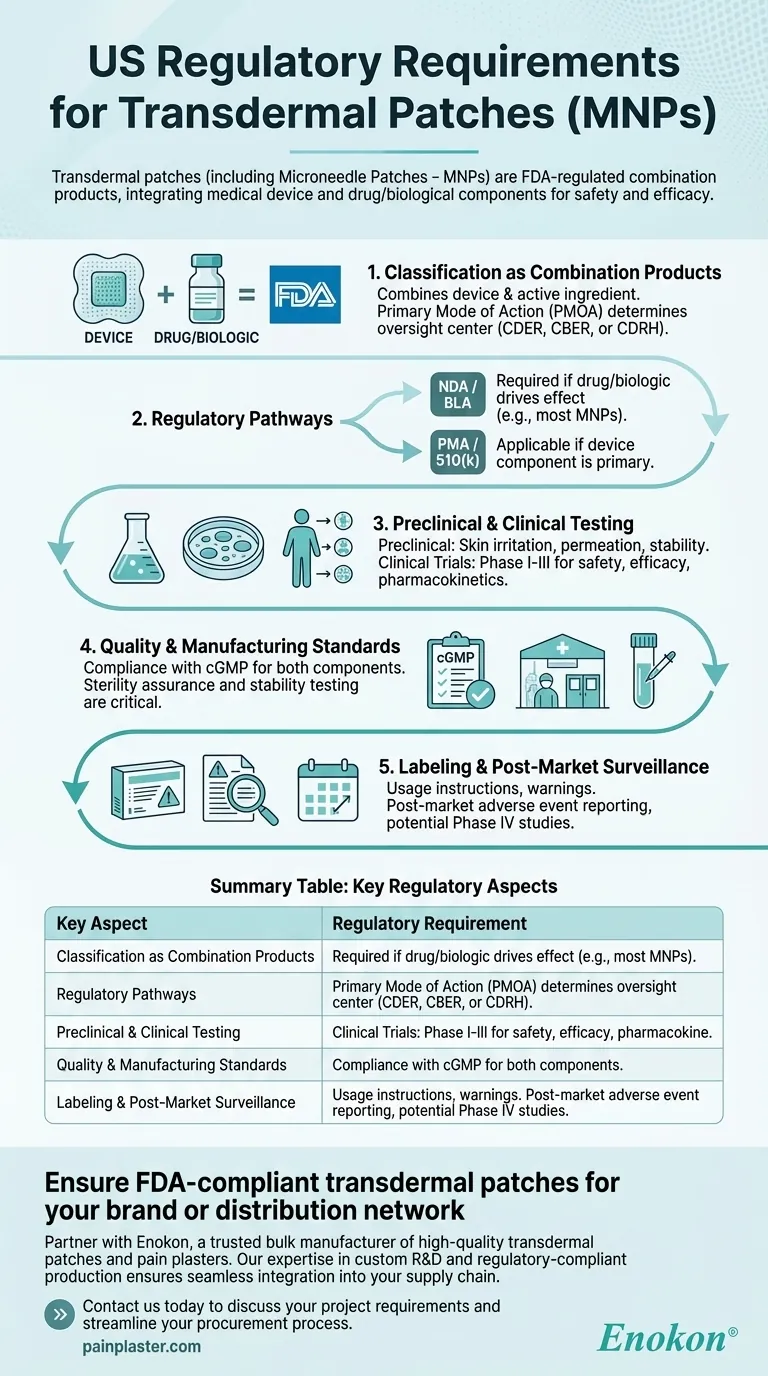
在美国,包括微针贴片 (MNPs) 在内的透皮贴片是由 FDA 监管的组合产品,需要严格的审批流程以确保安全性和有效性。这些产品集成了医疗器械和药物/生物成分,必须根据其主要作用方式遵守特定的监管途径。审批过程包括临床前和临床测试、质量控制以及遵守标签和生产标准。
要点说明:
-
组合产品分类
- 美国食品及药物管理局将 透皮贴剂 属于复合产品,因为它们结合了医疗器械(如贴片衬底、微针)和药物或生物活性成分。
- 主要作用模式 (PMOA) 决定了该产品是由药物评价和研究中心 (CDER)、生物制品评价和研究中心 (CBER) 还是器械和放射卫生中心 (CDRH) 监管。
-
监管途径
- 新药申请 (NDA) 或生物制品许可申请 (BLA):如果药物或生物制剂成分能产生治疗效果,则需要提交。
- 上市前批准 (PMA) 或 510(k):如果器械组件是主要的(如促进给药的微针),则适用。
- 由于微针具有以药物为中心的功能,因此通常采用 NDA/BLA 途径。
-
临床前和临床试验
- 临床前研究:包括皮肤刺激性、渗透性和稳定性测试,以评估安全性和给药效率。
- 临床试验:I-III 期试验评估人体药代动力学、药效和不良反应。
-
质量和生产标准
- 药品和器械组件均符合现行药品生产质量管理规范 (cGMP)。
- 无菌保证和稳定性测试对于生物制剂贴片至关重要。
-
标签和上市后监督
- 标签必须包括使用说明、警告和储存条件。
- 上市后要求包括不良事件报告和潜在的第四阶段研究。
对于采购商来说,了解这些要求可确保与符合 FDA 要求的供应商保持一致,从而降低不合格产品的风险。您是否考虑过这些法规对您的采购时间表或供应商选择标准有何影响?设备和药品监督的相互作用悄然影响着现代透皮疗法的可靠性。
汇总表:
| 关键方面 | 法规要求 |
|---|---|
| 分类 | 作为组合产品(器械+药物/生物制品)由 FDA 监管。 |
| 主要作用方式 | 决定由 CDER(药物)、CBER(生物制剂)或 CDRH(器械)监管。 |
| 审批途径 | NDA/BLA(药物驱动)或 PMA/510(k)(器械驱动)。MNP 通常遵循 NDA/BLA。 |
| 测试要求 | 临床前(安全性、渗透性)和临床试验(I-III 期)。 |
| 生产标准 | 药品和器械成分均符合 cGMP 标准;生物制剂的无菌保证。 |
| 上市后义务 | 不良事件报告、IV 期研究和标签合规性。 |
确保您的品牌或分销网络的透皮贴片符合 FDA 标准
合作伙伴
伊诺康
合作,我们是值得信赖的高品质透皮贴片和止痛贴批量制造商。我们在定制研发和符合法规要求的生产方面拥有丰富的专业知识,可确保无缝集成到您的供应链中。
立即联系我们
讨论您的项目要求并简化您的采购流程。
图解指南