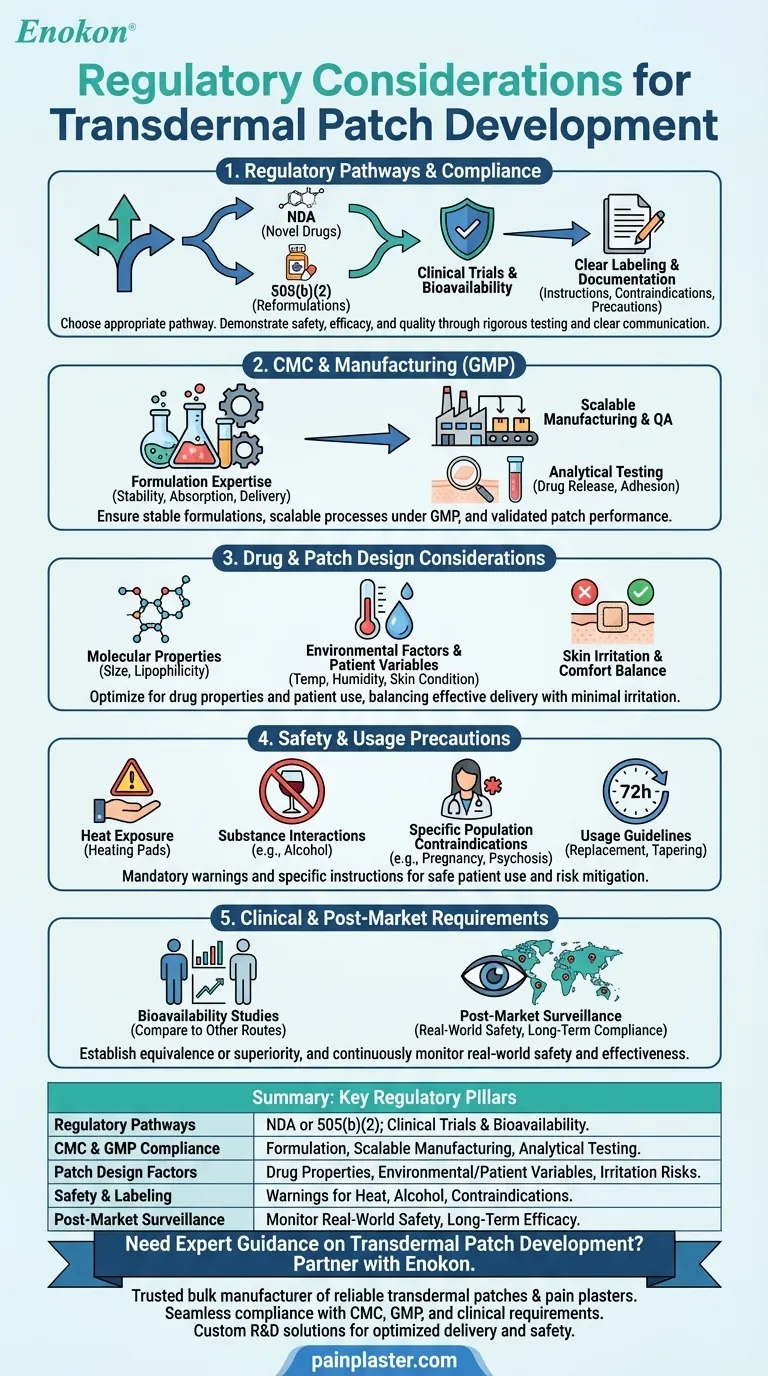
透皮贴剂的开发涉及到复杂的监管环境,以确保其安全性、有效性和质量。主要考虑因素包括符合化学、制造和控制(CMC)要求,遵守良好生产规范(GMP),以及对生物利用度和安全性进行全面的临床测试。药贴设计必须考虑药物特性(如分子大小、极性)和环境因素,同时标签和文件必须符合严格的标准。根据药物的新颖性,NDA 或 505(b)(2)等监管途径可能适用。此外,还必须解决皮肤刺激风险和使用限制(如避免高温暴露)等注意事项,以获得批准并确保患者安全。
要点说明:
-
监管途径与合规性
- 申办者必须在新药申请 (NDA) 和已批准药物的 505(b)(2) 重新配制之间做出选择。
- 符合 透皮贴剂 法规要求通过临床试验(包括生物利用度研究)证明其安全性、有效性和质量。
- 必须有清晰的标签和文件,详细说明使用说明、禁忌症(如与痴呆相关的精神病)和注意事项(如避免酒精或高温暴露)。
-
化学、制造和控制(CMC)
- 制剂专业知识对于确保药物的稳定性、吸收性和一致的给药速率至关重要。
- 商业生产过程中的可扩展性和质量保证必须符合 GMP 标准。
- 分析测试可验证药贴的性能,包括药物释放曲线和粘附性能。
-
药物和贴片设计注意事项
- 分子特性(如小尺寸、亲脂性)会影响吸收率,必须在开发过程中加以优化。
- 环境因素(温度、湿度)和患者特异性变量(皮肤状况、年龄)会影响药效,需要在实际条件下进行测试。
- 药贴必须兼顾给药和舒适,尽量减少对皮肤的刺激或过敏反应。
-
安全和使用注意事项
- 标签必须警告皮肤刺激、热暴露(如加热垫)以及与酒精等物质相互作用等风险。
- 特定人群(孕妇/哺乳期妇女、精神病患者)可能需要禁忌症。
- 使用指南(如每 72 小时更换一次、减量方案)必须明确告知患者。
-
临床和上市后要求
- 生物利用度研究将透皮给药与其他途径(如口服)进行比较,以确定等效性或优越性。
- 上市后监测可监控实际安全性,确保长期依从性并解决不可预见的不良反应。
通过解决这些方面的问题,开发人员可以在提供有效、方便患者的透皮疗法的同时,绕过监管障碍。您是否考虑过贴片粘合剂如何在不影响给药的情况下减少对皮肤的刺激?

汇总表:
| 主要监管考虑因素 | 详细信息 |
|---|---|
| 监管途径 | 新药的 NDA;复方制剂的 505(b)(2)。要求进行临床试验和生物利用度研究。 |
| CMC 和 GMP 合规性 | 制剂稳定性、规模化生产和分析测试(药物释放、粘附)。 |
| 药贴设计因素 | 优化药物特性(大小、亲脂性)、环境/患者变量以及皮肤刺激风险。 |
| 安全与标签 | 警告高温暴露、酒精相互作用以及高危人群的禁忌症。 |
| 上市后监测 | 监测批准后的实际安全性和长期疗效。 |
在透皮贴剂开发方面需要专家指导? 与 Enokon Enokon 是一家值得信赖的大宗生产商,为医疗保健品牌和分销商提供可靠的透皮贴剂和止痛贴。我们的技术专长可确保无缝符合 CMC、GMP 和临床测试要求,而我们的定制研发解决方案可优化药物输送和患者安全。 今天就联系我们 讨论您的项目!
图解指南