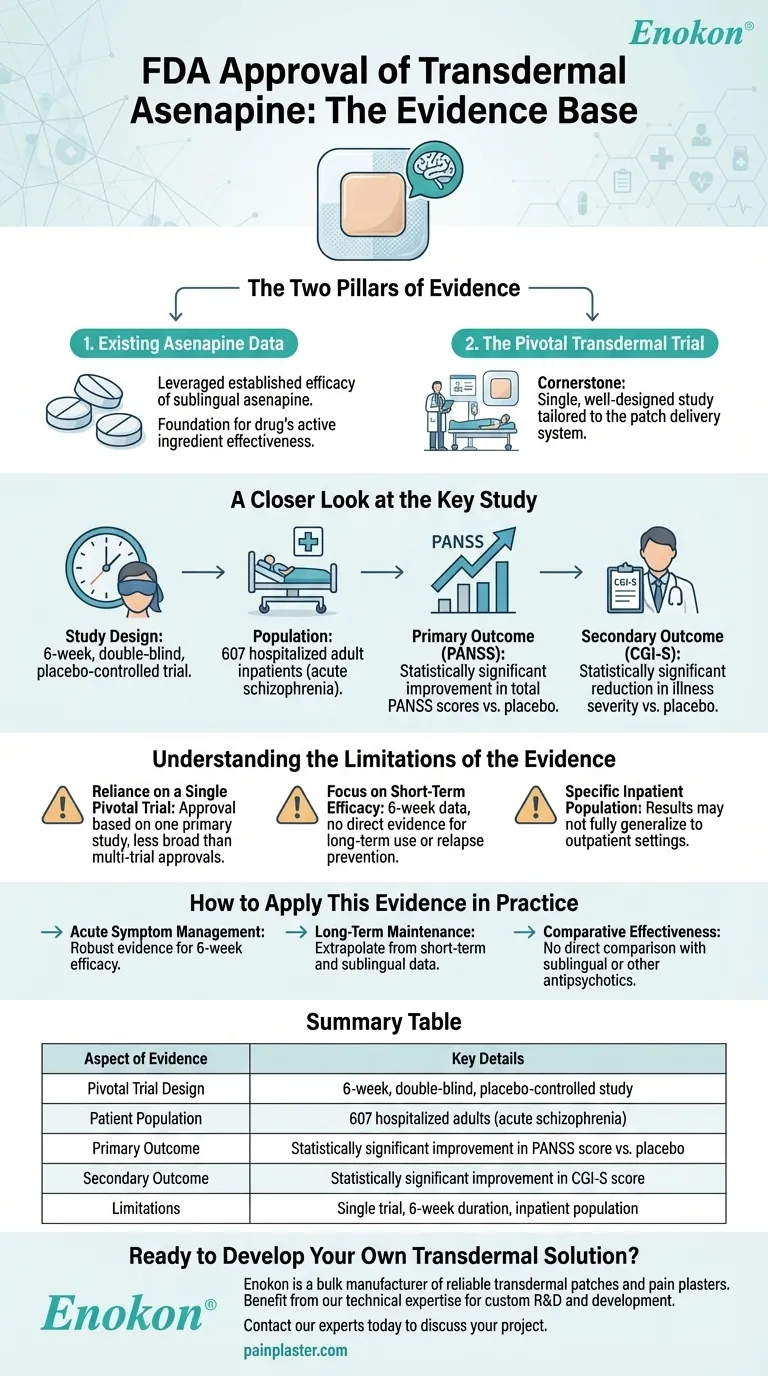
美国食品和药物管理局批准 阿塞那平贴片 (透皮阿塞那平贴片)得到了之前舌下含服阿塞那平研究的疗效数据和一项关键的 6 周双盲安慰剂对照试验的综合支持,该试验涉及 607 名成年精神分裂症住院患者。与安慰剂相比,透皮制剂在主要终点(PANSS 评分)和次要终点(CGI-S 评分)方面均有统计学意义的显著改善,证实了其治疗效果。这些证据共同证实了该贴片治疗精神分裂症的安全性、有效性和临床相关性。
要点说明:
-
先前的阿塞那平舌下含服疗效数据
- 早期评估舌下阿塞那平的试验为该药物在精神分裂症中的作用机制和治疗潜力提供了基础证据。
- 这些研究可能为透皮制剂的剂量、安全性和预期疗效提供了依据,从而简化了审批程序。
-
关键性 6 周双盲试验
- 研究设计:一项严格的安慰剂对照试验有 607 人参加,确保了强大的统计能力,并最大限度地减少了偏差。
- 研究对象:重点关注成年精神分裂症住院患者,反映了临床使用的目标人群。
- 持续时间:6 周的时间框架兼顾了急性症状评估和实际临床应用。
-
主要终点PANSS 评分
- 阳性和阴性综合量表 (PANSS) 是评估精神分裂症症状严重程度的黄金标准。
- PANSS 评分在统计学上的明显改善证实了贴剂在减轻阳性症状(如幻觉)和阴性症状(如社交退缩)方面的疗效。
-
次要终点:CGI-S 评分
- 临床整体印象-严重程度(CGI-S)量表提供了临床医生报告的症状改善验证。
- 其显著性加强了患者的特异性和可观察到的临床疗效。
-
安全性和耐受性
- 虽然参考文献中没有明确详细说明,但 FDA 的批准意味着透皮制剂达到了安全基准,很可能是利用了舌下含服数据和新的试验不良事件报告。
- 透皮给药可能具有减少全身副作用等优势(例如,与口服或注射途径相比)。
-
监管理由
- FDA 的决定取决于可重复的疗效(PANSS/CGI-S)和对照试验数据支持下明确的风险-收益特征。
- 该贴片的便利性和依从性优势(如持续释放、非口服途径)可能进一步证明了该药物获得批准的合理性,而这一人群往往面临服药依从性方面的挑战。
对于医疗保健购买者来说,这些证据强调了 阿塞那平贴片 作为精神分裂症治疗的一种可行的、有证据支持的选择,它在给药和耐受性方面具有潜在的优势。它的透皮形式是否符合您的患者需求或机构协议?
汇总表:
| FDA 批准的关键证据 | 详细信息 |
|---|---|
| 阿塞那平舌下含服之前的数据 | 确定的作用机制和安全性概况 |
| 为期 6 周的关键性试验 | 607 名成年精神分裂症住院患者,双盲、安慰剂对照 |
| 主要终点(PANSS 评分) | 症状明显减轻 |
| 次要终点(CGI-S 评分) | 临床医生确认的严重程度改善 |
| 安全性和耐受性 | 符合 FDA 基准,具有潜在的依从性优势 |
| 监管理由 | 可重复的疗效和明确的风险收益特征 |
有兴趣将透皮阿塞那平纳入您的治疗方案吗?
作为一家值得信赖的透皮贴剂和止痛贴批量生产企业,我们为您提供以下服务 伊诺康 为医疗保健分销商和制药品牌提供可靠、经过临床验证的解决方案。我们在定制研发方面的专业知识可确保配方符合您的患者需求。
立即联系我们 讨论合作机会或索取产品样品。
图解指南